قوانين الغازات ..
قانون بويل /
قوانين الغازات ..
قانون شارل /
قوانين الغازات ..
قانون جاي لوسك /
قانون بويل /
قانون بويل هو إحدى قوانين الغازات والتي على أساسها تم اشتقاق قانون الغاز المثالي.
قام العالم روبيرت بويل بتثبيت درجة حرارة الغاز (T) وقام بقياس تغير حجم الغاز (V) بتغير ضغطه (P)، واكتشف أن هناك علاقة تناسب عكسي بين الضغط والحجم .
بمعنى انه إذا زاد الضغط قل الحجم بنفس النسبة ،وكلما زاد الحجم قل الضغط وذلك مع الاحتفاظ بدرجة حرارة ثابتة . تصاغ تلك العلاقة كالآتي :
-
- V=1/P
"عند درجة حرارة ثابتة , عندما يتغير ضغط كمية معينة من غاز يتناسب الحجم عكسيا مع تغير الضغط ."
يمكن تمثيل ذلك رياضياً بالقانون:
حيث :
- P : ضغط الغاز ويقاس بعدة وحدات منها مم زئبق ، أو بار ، أو باسكال ،
- V : حجم الغاز ويقاس بعدة وحدات منها لتر ، أو سنتيمتر3، ديسيلتر وغيرها.
- k : ثابت
كما قام بعمل علاقه أخرى بين حجم الهواء والكثافه واكتشف ان هناك علاقه عكسيه حيث يزداد حجم الهواء كلما قلت كثافته .
قوانين الغازات ..
قانون شارل /
قام العالم تشارل بتثبيث ضغط الغاز ودرس العلاقة بين درجة الحرارة وحجم الغاز. واكتشف العالم جاك شارل عام 1787م ان عند ثبات ضغط كتلة معينة من غاز يتناسب حجمها تناسبا طرديا مع درجة حرارتها المطلقة ونستنتج القانون التالي:
حيث أن:
- V:حجم الغاز
- T:درجة حرارة الغاز مقاسة بالكلفن
- k: ثابت
ومنه ينتج أن:
قوانين الغازات ..
قانون جاي لوسك /
ينص هذا القانون على أن ضغط غاز مثالي يتغير تغيرا طرديا مع درجة الحرارة عند ثبات الحجم . تقاس درجة الحرارة هنا بالكلفن كما يفترض ثبات كمية الغاز . معنى ذلك أن ضغط الغاز يزداد بالتسخين و يقل عند فقده حرارة . وقد اكتشف هذا الاعتماد بين ضغط الغاز ودرجة الحرارة جاك شارلز عام 1787 و العالم والفيزيائي الفرنسي جوزيف جاي-لوساك في عام 1802 :
فعندما يكون الحجم V ثابتا و كذلك كمية n المادة ثابتة تنطبق المعادلة :
نستنتج من قانون جاي-لوساك أنه لا بد من وجود الصفر المطلق لدرجة الحرارة حيث تتنبأ المعادلة بحجم "صفري" عند درجة الصفر المطلق ، إذأن الحجم لا يمكن أن يكون سالبا الإشارة (أقل من الصفر). كما يشكل استنباط القانون من قياسات معملية أساسا لمقياس درجة الحرارة بالكلفن ، حيث استنبطت درجة الصفر المطلق وعُينت عن طريق تمديد القياسات العملية إلى وصول الحجم إلى قيمة الصفر.
P: الضغط
T: درجه الحراره

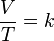


ليست هناك تعليقات:
إرسال تعليق